Cieľom projektu EPCS III je objektivizácia prínosu miniinvazívnej algeziologickej techniky u pacientov s vertebroalgickým syndrómom a kvantifikácia dlhodobej úľavy od bolesti a zlepšenie kvality života pacientov po výkone Disc FX na medzistavcovej platničke u vybranej skupiny pacientov po splnení indikačných kritérií.
Štúdia bola 23. 4. 2015 schválená regionálnou etickou komisiou pod číslom EK: 9N-2015. Následne bola zaregistrovaná v medzinárodnej databáze National Health Service USA https://clinicaltrials.gov PRS: NCT02461654
EPCS 3 Approval document.
Projekt spĺňa všetky atribúty a platné legislatívne normy týkajúce sa medicínskeho výkonu schváleného Ministerstvami zdravotníctva v SR a ČR.
Detail štúdie
Štúdia EuroPainClinics®Study III (EPCS III) je zameraná na klinický výskum liečebnej metódy Disc FX.
Disc FX – indikačné kritéria
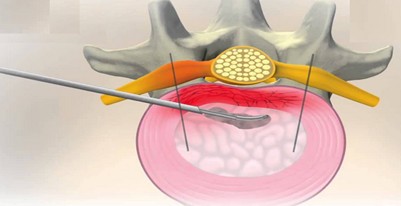
Disc FX je inovatívny systém umožňujúci bezpečný a účinný prístup k postihnutej medzistavcovej platničke bez poškodenia okolitých štruktúr. Táto metóda poskytuje možnosť tým, u ktorých nebola úspešná konzervatívna liečba a ešte nie sú pripravení na zložitú operáciu. Ide o miniinvazívny zákrok vykonávaný ambulantne. Realizácie výkonu spočíva v napichnutí platničky špeciálnou ihlou, ktorá slúži ako pracovný kanál. Cez túto ihlu sa vyberie časť degenerovaného vnútorného tkaniva. Potom sa rádiofrekvenčnou sondou platnička zataví, aby sa znížilo riziko opakovanej herniácie.
Na záver sa rádiofrekvenčne zničia patologické nervy v zadnej časti platničky. Štúdia EPCS III je zameraná na sledovanie dlhodobej úľavy od bolesti a zlepšenie kvality života u vybranej skupiny pacientov, ktorí podstúpili miniinvazívny výkon na medzistavcovej platničke Disc FX.
Predmet štúdie EPCS III a registrácia
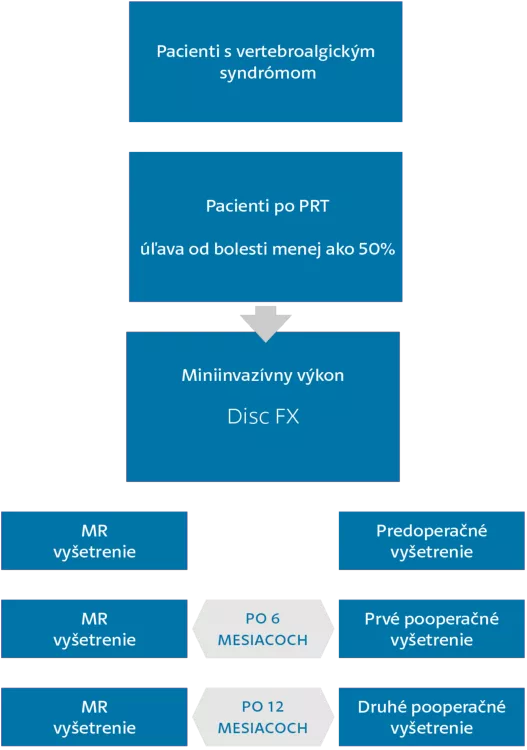
Predmetom projektu je realizácia multicentrickej prospektívnej observačnej klinickej štúdie zaoberajúcej sa porovnaním vývoja klinického stavu pacienta v 3 časových úsekoch a to: pred výkonom, po 6 mesiacov od výkonu a 12 mesiacov od výkonu.
Štúdia bola pripravená a vypracovaná organizáciou Europainclinics z.ú. Po vypracovaní dizajnu štúdie, príprave informovaných súhlasov pre jej účastníkov a vyhotovení protokolu bola štúdia 23. 4. 2015 schválená regionálnou etickou komisiou pod číslom EK: 9N-2015 . Následne bola zaregistrovaná v medzinárodnej databáze National Health Service USA https://clinicaltrials.gov PRS: NCT02461654.
Projekt spĺňa všetky atribúty a platné legislatívne normy týkajúce sa medicínskeho výkonu schváleného Ministerstvami zdravotníctva v SR a ČR. Spracovanie osobných údajov pacientov za účelom vedenia štúdie je v súlade so súčasnou verziou Helsinskej deklarácie z roku 2008 a v súlade s príslušnými zákonmi danej krajiny. Bude zachovaná ochrana osobných údajov pacienta. S dátami sa bude nakladať podľa smerníc EU: Smernice 95/46/EC, Smernice 2002/58/EC, Smernice 2006/24/EC. Bude zaistené, aby protokol štúdie, informované súhlasy s intervenčným výkonom a so zaradením do prebiehajúcej štúdie boli podľa miestnych požiadaviek poskytnuté príslušnej nezávislej etickej komisii. V prípade, že to zákony danej krajiny vyžadujú, je spoločnosť EuroPainClinics z.ú. zodpovedná za poskytnutie každoročnej aktualizácie dokumentácie nezávislej etickej komisii. Výsledky dosiahnuté v štúdii budú publikované v odborných medzinárodných periodikách a zohľadnené v odporúčaniach a postupoch v klinickej praxi intervenčnej algeziológie.
Ciele štúdie EPCS III a sledované parametre
Cieľom projektu je objektivizovanie prínosu miniinvazívnej algeziologickej techniky u pacientov s vertebroalgickým syndrómom a kvantifikovanie dlhodobej úľavy od bolesti a zlepšenie kvality života pacientov po výkone Disc FX. Získané výsledky budú porovnané s výsledkami iných algeziologických pracovísk sveta.
Zo sledovaných parametrov sa bude porovnávať klinický stav, vizuálna škála bolesti, globálne skóre bolesti, šírenie bolesti v príslušných dermatómoch, redukcia spotreby analgetík, Oswestry disability dotazník (poukazujúci na kvalitu života u pacientov s bolesťou lumbosakrálnej chrbtice). Sledované parametre budú zaznamenávané v troch časových periódach a to: pred výkonom (prvé vyšetrenie), následne 6 mesiacov po výkone (druhé vyšetrenie) a nakoniec 12 mesiacov po výkone (tretie vyšetrenie). Výsledky budú následne podrobené štatistickej analýze. Ďalším cieľom projektu je zverejnenie zistených výsledkov v odborných medzinárodných periodikách.
